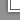На первом этапе в пробе крови оценивают уровень РАРР-А (в 8—11 нед) и определяют величину воротникового пространства (NT) с 11 до 13 нед беременности.
На втором этапе с 16 до 22 нед беременности в пробе крови определяют уровень АФП, неконъюгированного Э3, ингибина А и ХГ.
При скрининг-положительных результатах для уточнения диагноза целесообразно выполнение УЗИ и амниоцентеза с последующим исследованием околоплодных вод.
Результаты интегрального теста не интерпретируются, если нет одного из двух образцов крови.
Использование серологических тестов в акушерской практике позволяет отнести пациентку в определенную группу риска по той или иной патологии. К сожалению, тесты не дают возможности выявить абсолютно всех беременных, у которых имеются те или иные осложнения, определяемые с помощью этих тестов.
Оба теста позволяют разделить всех обследованных пациенток на две группы согласно их риску.
1. Скрининг-положительная группа. При использовании интегрированного теста приблизительно 2% всех обследованных женщин попадает в группу скрининг-положительных по возможности наличия синдрома Дауна у плода. Интегральный тест идентифицирует около 90% плодов с синдромом Дауна. Ложноположительным тест будет приблизительно в 2% результатов.
При использовании квадро-теста позитивный результат, как правило, выявляется у 80% пациенток при наличии у плода синдрома Дауна. Ложноположительные результаты при этом будут получены в 7% наблюдений.
Если уровень АФП составляет 2,5 МоМ или выше, результат интерпретируется как скрининг-положительный по возможности наличия дефекта нервной трубки.
Приблизительно 1 из 67 женщин окажется в скрининг-положительной группе. Применение квадро-теста и интегрального теста позволяет выявить 90% плодов со spina bifida и почти 100% — с анэнцефалией.
Ложноположительным тест будет приблизительно в 1,5% результатов для дефекта нервной трубки.
Высокий риск для трисомии 18-й пары хромосом в рамках применения квадро-теста и интегрального теста может быть оценен с учетом возраста беременной и серологических уровней АФП, Э3 и ХГ. Только около 0,3% женщин войдет в группу риска по данной патологии. Для трисомии 18-й пары хромосом вероятность ее выявления с помощью квадро-теста составляет 60%, а для интегрального теста — 80%.
При выявлении скрининг-положительных результатов целесообразно провести детальное УЗИ и выполнить цитогенетическое исследование околоплодных вод, полученных с помощью амниоцентеза.
В частности, при подозрении на наличие синдрома Дауна с помощью УЗИ проводят поиск характерных морфологических дефектов (врожденные пороки сердца), а также ряда вспомогательных эхографических маркеров, к которым относят укорочение длины конечностей. Могут также определяться такие маркеры, как повышенная эхогенность петель кишечника, пиелэктазия и др.
В том случае если результаты обследования подтверждают наличие осложнения, за женщиной всегда остается право выбора дальнейшего характера ведения данной беременности.
2. Скрининг-отрицательная группа. Скрининг-отрицательный результат означает, что риск беременности плодом с синдромом Дауна, дефектом нервной трубки или трисомии 18-й пары хромосом ниже определенной границы риска. Это не исключает возможность беременности с патологией плода.
На результаты тестов оказывают влияние целый ряд факторов, который необходимо учитывать при интерпретации результатов диагностики.
Риск возникновения осложнений при беременности с возрастом увеличивается. Следовательно, женщина старшего возраста с большей вероятностью будет иметь положительный результат скрининга. Этот фактор учитывается в расчетах. Но независимо от возраста риск должен быть все равно оценен в совокупности с сывороточными маркерами. Серологические уровни маркеров имеют тенденцию к снижению у женщин с избыточной массой тела и тенденцию к увеличению у хрупких женщин.
Уровень ХГ приблизительно на 10% выше, а уровень Э3 примерно на 10% ниже у женщин, забеременевших в результате ЭКО, по сравнению с женщинами, у которых беременность наступила естественным образом.
В I и II триместрах серологические уровни изучаемых маркеров повышены при многоплодной беременности.
У женщин с инсулинзависимым сахарным диабетом уровень АФП снижен приблизительно на 18%, а уровни Э3 и ингибина А уменьшены соответственно на 6 и 12%
.Следовательно, вклад каждого маркера в оценку риска при сахарном диабете и многоплодной беременности точно рассчитать невозможно. Таким образом, оба эти состояния являются противопоказаниями для скрининга беременности плодом с синдромом Дауна.
В случае кровотечения, которое возникло перед взятием пробы крови, возможно увеличение в сыворотке содержания изучаемых маркеров. В этом случае целесообразно отложить исследование на 1 нед после остановки кровотечения.
Чрезмерное повышение уровней АФП и ХГ в сыворотке крови, зафиксированное во II триместре беременности, увеличивает риск возможных осложнений в ходе III триместра.
В частности, повышение уровня АФП взаимосвязано с повышенным риском последующего возникновения гестоза, задержки развития плода, отслойки плаценты и преждевременных родов.
Увеличение содержания ХГ в сыворотке крови во II триместре беременности сопряжено с высоким риском развития гестоза и смерти плода, отслойки плаценты.
В начале беременности развитие ФПН часто сопровождается недостаточной функцией желтого тела, что в первую очередь характеризуется снижением ХГЧ и прогестерона.
Одним из наиболее частых проявлений ФПН является угроза прерывания беременности.
В I триместре беременности диагностическое значение имеют гормоны белкового происхождения. Определение ХГ и ПЛ является информативным при эндокринном генезе невынашивания беременности с первичным нарушением функции трофобласта. При начавшемся выкидыше снижение уровня плацентарных гормонов происходит уже независимо от причины невынашивания.
Во II и III триместрах беременности развитие ФПН чаще всего сопровождается патологическими морфофункциональными изменениями плаценты, что приводит к снижению синтеза всех гормонов фетоплацентарной системы. При этом функциональное состояние плаценты в большей степени влияет на уровень ПЛ и прогестерона, а состояние плода отражается на выработке эстриола.
Характер морфофункциональных нарушений фетоплацентарного комплекса в первую очередь зависит от степени выраженности ФПН и этиологических факторов ее развития.
При легкой степени гестоза нарушения синтеза гормонов встречаются редко. Для гестоза средней и особенно тяжелой степени характерно более частое и выраженное снижение ПЛ, Э3 и прогестерона.
При наличии пиелонефрита, протекающего у беременных без артериальной гипертензии и почечной недостаточности, средний уровень гормонов находится в пределах допустимых колебаний (крайние значения нормальных показателей), характерных для здоровых беременных. У больных с хроническим пиелонефритом, который сопровождается почечной гипертензией, гестозом, задержкой развития плода, имеет место сниженное содержание ПЛ, Э3 и прогестерона. При тяжелой форме пиелонефрита и почечной недостаточности концентрация указанных гормонов возрастает на 50—100% вследствие снижения выделительной функции почек.
У беременных с хроническим гломерулонефритом снижение гормональных показателей наблюдается особенно часто, начиная уже с 24—25 нед. При этом концентрация гормонов продолжает оставаться на низком уровне до окончания беременности.
При изосерологической несовместимости крови матери и плода без явлений изосенсибилизации уровень гормонов не отличается от нормативных показателей.
Течение тяжелых форм сенсибилизации с нарушением функции фетоплацентарной системы сопровождается возрастанием уровня ПЛ в 1,5— 2 раза в соответствии с патологическим увеличением массы плаценты и снижением концентрации Э3 вследствие страдания плода.
Повышение уровня ПЛ более чем на 30% по сравнению с нормативным показателем, характерным для данного срока беременности, является неблагоприятным признаком, указывающим на тяжелую форму гемолитической болезни.
Сходная динамика изменения уровня гормонов имеет место у беременных с сахарным диабетом.
Результаты гормональных исследований в совокупности с данными других методов диагностики используются для выработки тактики ведения беременной.
При снижении на 50% содержания одного из гормонов по сравнению с нормативными показателями следует госпитализировать беременную, провести углубленное исследование состояния фетоплацентарной системы и соответствующую терапию.
Досрочное родоразрешение в интересах плода целесообразно при наличии низкого уровня гормона во время повторного исследования или при одновременном снижении на 50% двух-трех показателей.
Уменьшение концентрации гормонов на 70— 80%, как правило, является признаком тяжелого состояния плода или его смерти.
4.8. Инвазивные методы исследованияДля оценки характера течения беременности и состояния плода в целом ряде случаев используют методы инвазивной диагностики, ряд из которых выполняют при эхографическом контроле.
Значительную часть пренатальных инвазивных исследований составляет цитогенетическая диагностика хромосомных болезней. В этих случаях показаниями для ее проведения являются: возраст матери 35 лет и старше; рождение в семье ребенка с хромосомной патологией; носительство семейной хромосомной аномалии; подозрение на наличие у плода врожденных пороков развития; наличие эхографических признаков хромосомной патологии; отклонение уровней сывороточных материнских маркеров.
Выбор метода инвазивной диагностики определяется соответствующими показаниями, сроком беременности, состоянием беременной женщины, учитывают также согласие ее.
В I триместре беременности чаще всего проводят трансцервикальную или трансабдоминальную аспирацию ворсин хориона. Во II триместре выполняют амниоцентез, трансабдоминальную аспирацию ворсин плаценты и трансабдоминальный кордоцентез (пункция сосудов пуповины).
Инвазивные вмешательства проводят при наличии результатов гинекологического обследования беременной и данных лабораторных исследований (анализ крови и мочи, тесты на сифилис, ВИЧ, гепатит В и С, анализ мазка влагалищного отделяемого и др. — по показаниям).
4.8.1. Исследование околоплодных водОпределение таких характеристик околоплодных вод, как количество, цвет, прозрачность, цитологический и биохимический состав, содержание гормонов, в ряде случаев имеет важное диагностическое значение для оценки характера течения беременности и состояния плода.
Определить объем околоплодных вод можно с помощью как клинических методов исследования (измерение длины окружности живота и высоты стояния дна матки, пальпация), так и с помощью ультразвуковой диагностики. При использовании этих методов наиболее точные результаты, свидетельствующие об аномальном количестве околоплодных вод, могут быть получены при выраженном маловодий или многоводии.
При пограничных ситуациях, проявляющихся относительным или умеренным маловодием или многоводием, оценка объема околоплодных вод в значительной степени субъективизирована. Даже при УЗИ с вычислением индекса амниотической жидкости диагностическая ценность метода является низкой.
При подозрении на аномальное количество околоплодных вод важным диагностическим критерием является динамический контроль за темпами изменения их количества.
С помощью амниоскопии проводят трансцервикальный осмотр нижнего полюса плодного пузыря, что дает возможность определить цвет околоплодных вод, их консистенцию, выявить примесь мекония или крови, наличие хлопьев сыровидной смазки. Показаниями для этой диагностической процедуры являются подозрение на хроническую гипоксию плода, перенашивание беременности, изосерологическая несовместимость крови матери и плода. К противопоказаниям относятся воспалительные заболевания влагалища и шейки матки, предлежание плаценты.
Получить околоплодные воды для биохимического, гормонального, иммунологического, цитологического или генетического исследования можно с помощью амниоцентеза.
 Рис. 4.42. Амниоцентез. Трансабдоминальный доступ.
Рис. 4.42. Амниоцентез. Трансабдоминальный доступ.1 — шейка матки; 2 — влагалище; 3 — амниотическая жидкость; 4 — матка; 5 — плацента.
Показаниями для данной диагностической процедуры чаще всего является необходимость цитогенетической диагностики хромосомных болезней. В более редких случаях амниоцентез выполняют при гипоксии плода, изосерологической несовместимости крови матери и плода, для оценки степени зрелости плода (по соотношению концентрации лецитина и сфингомиелина или по количеству безъядерных липидосодержащих «оранжевых» клеток), необходимости микробиологического исследования околоплодных вод. Противопоказания — угроза прерывания беременности и инфицирование половых путей. Процедуру выполняют под ультразвуковым контролем, выбирая доступ в зависимости от расположения плаценты и плода. При этом проводят как трансабдоминальный (рис. 4.42), так и трансцервикальный амниоцентез.
Среди осложнений этой манипуляции отмечаются преждевременное излитие околоплодных вод, преждевременные роды, ранение плода, отслойка плаценты, повреждение пуповины, ранение мочевого пузыря и кишечника матери, хориоамнионит.
4.8.2. Исследование крови плодаРезультаты исследования крови плода, полученной из пуповины или из сосудов кожи головки, дают достоверную и важную информацию о его состоянии.
Кровь из сосудов пуповины получают путем трансабдоминального кордоцентеза, который заключается в пункции сосудов пуповины под эхографическим контролем.
Показаниями для выполнения этой диагностической процедуры являются необходимость диагностики хромосомных болезней у плода путем кариотипирования, подозрение на внутриутробную инфекцию, гипоксия плода, изосерологическая несовместимость крови матери и плода. Кордоцентез проводят после 18 нед беременности. Противопоказания те же, что и при выполнении амниоцентеза.
Среди осложнений наиболее частыми являются преждевременное излитие околоплодных вод, преждевременное прерывание беременности, кровотечение из пунктируемого сосуда.
Во время родов для исследования капиллярной крови плода ее получают из сосудов кожи головки с помощью амниоскопа. В полученной пробе крови оценивают величину рН (концентрация свободных ионов водорода). При величине рН более 7,25 считают, что плод не страдает от гипоксии и состояние его квалифицируется как нормальное. Если величина рН находится в пределах от 7,20 до 7,24, то считают, что плод испытывает умеренную гипоксию и необходимо предпринять меры для повышения степени его оксигенации. Величина рН ниже 7,20 свидетельствует о выраженной гипоксии плода, сопровождающейся метаболическим ацидозом, что требует экстренного родоразрешения.
4.8.3. Кислородная сатурация плода в родахОдним из современных объективных и безопасных методов оценки функционального состояния плода во время родов является пульсоксиметрия, представляющая собой неинвазивный метод непрерывного определения кислородной сатурации плода (SpO2), отражающей насыщение гемоглобина артериальной крови кислородом.
Величина сатурации выражается в процентном отношении уровня оксигемоглобина к сумме концентраций оксигемоглобина и дезоксигенированного гемоглобина (за исключением карбоксигемоглобина и метгемоглобина):

В современных приборах методика определения величины сатурации основана на двух принципах. Во-первых, оксигемоглобин и дезоксигенированный гемоглобин обладают различной способностью поглощать и отражать свет в зависимости от его длины волны. В используемых датчиках светодиоды излучают поочередно красный и инфракрасный свет, которые имеют различную длину волны.
Во-вторых, объем артериальной крови в тканях и соответственно способность поглощения света кровью меняется вследствие ее пульсации, обусловленной сердцебиениями. Во время систолы вследствие увеличения объема крови в ткани поглощение света усиливается, а в диастолу соответственно уменьшается. При этом обратно пропорционально изменяется и количество отраженного света.
В применяемых для исследования приборах датчик пульсоксиметра должен находиться в прямом контакте с кожей плода. Фотодетектор датчика, располагающийся в одной плоскости со светоизлучающими элементами, измеряет отраженный свет, величина которого находится в обратной зависимости от количества поглощенного света.
Анализируя характеристики красного и инфракрасного света, отраженного от располагающегося под датчиком потока крови, пульсоксиметр оценивает величину сатурации в процессе исследования.
Современные пульсоксиметры откалиброваны в соответствии со стандартами величин сатурации, измеренных в образцах крови плода в процессе родов, которые достоверно отражают гипоксию плода.
Пульсоксиметрию используют в родах при головном предлежании плода, отсутствии плодного пузыря и открытии шейки матки не менее чем на 3 см. Противопоказаниями к применению методики являются кровяные выделения из половых путей, предлежание плаценты, многоплодная беременность, наличие инфекций, рубец на матке.
Перед началом исследования датчик пульсоксиметра, введенный в полость матки, располагают на щеке плода или в височной части, свободной от волос, что исключает искажение отраженного светового сигнала.
Изогнутая форма рабочей поверхности датчика и давление со стороны стенок матки позволяют плотно фиксировать его на головке плода в месте приложения. При этом датчик не травмирует ткани родовых путей матери" и ткани плода. Время регистрации SpO2 составляет 60 мин и более. В ряде случаев датчик может плохо удерживаться между головкой плода и внутренней поверхностью стенки матки при неправильном вставлении головки плода.
При нормальном течении родов величина сатурации варьирует в среднем от 45 до 65% и постепенно снижается на 5—10% от их начала до завершения.
При этом происходят определенные изменения величины сатурации в зависимости от фаз сокращения матки. Самые высокие значения SpO2 регистрируются в паузу между сокращениями матки. В начале схватки отмечается некоторое снижение величины сатурации с последующим увеличением на пике схватки (сопоставимым с величиной SpO2 между схватками) и достоверным снижением в конце схватки.
Характер изменений величины сатурации во время схваток обусловлен целым рядом факторов: изменениями гемодинамики в маточных артериях и в артериях пуповины, изменением величины внутриматочного давления, изменениями сердечного ритма плода.
При гипоксии плода показатели сатурации в среднем снижаются на 15—20% по сравнению с нормой. Степень снижения сатурации плода в родах находится в прямой зависимости от тяжести гипоксии.
При нарушении состояния плода также прослеживается закономерность изменения величины SpO2 в зависимости от фаз сокращения матки. Снижение величины SpO2, отмечающееся в начале схватки, приобретает наиболее выраженный характер на пике сокращения матки с последующим повышением по мере расслабления матки. Чем в большей степени выражена гипоксия, тем ниже величина SpO2 на пике схватке. Подобные изменения являются неблагоприятным прогностическим признаком, сопряженным с высоким риском развития у плода осложнений гипоксического генеза.
Метод фетальной пульсоксиметрии имеет ряд преимуществ по сравнению с другими методами оценки состояния плода в родах, так как быстрее реагирует на изменение содержания кислорода в крови плода. Однако пульсоксиметрию наиболее целесообразно использовать в том случае, если по данным КТГ отмечаются признаки, указывающие на выраженные нарушения со стороны плода. Сатурация менее 30% является критической величиной для плода.
Быстрое снижение величины сатурации до уровня менее 30%, особенно в сочетании с неблагоприятными признаками КТГ (брадикардия, снижение вариабельности базального ритма, глубокие поздние децелерации), является показанием к абдоминальному родоразрешению в экстренном порядке. Однако если имеется возможность, то целесообразно провести оценку величины рН крови из сосудов кожи головки плода. Если при этом величина рН более 7,25, то можно продолжить ведение родов через естественные родовые пути. При рН от 7,24—7,20 и ниже необходимо экстренное абдоминальное родоразрешение.
Если на фоне неблагоприятных признаков КТГ величина сатурации более 30%, то на самом деле имеет место адекватное снабжение плода кислородом и он не испытывает гипоксии.
Прослеживается четкая взаимосвязь между степенью насыщения гемоглобина кислородом артериальной крови плода в родах и состоянием новорожденных. Низкие показатели FSpO2 (менее 30%) коррелируют и с низкими уровнями рН крови новорожденных (рН увеличением дефицита оснований (BE) и снижением количества буферных оснований (ВВ), что в совокупности указывает на гипоксию у новорожденных, сопровождающуюся метаболическим ацидозом. Показатели КОС и газовый состав крови у новорожденных свидетельствуют о степени перенесенной гипоксии в интранатальном периоде, что подтверждается низкой оценкой по шкале Апгар при рождении и клиническими проявлениями осложнений гипоксического генеза.
Следовательно, результаты фетальной пульсоксиметрии позволяют не только своевременно решить вопрос о тактике ведения родов и выбрать оптимальный способ родоразрешения, но и прогнозировать перинатальные исходы.
Метод пульсоксиметрии прост в применении и может быть использован в родовспомогательных учреждениях любого уровня. Применение фетальной пульсоксиметрии не увеличивает риск внутриутробного инфицирования плода и не увеличивает частоту послеродовых гнойно-воспалительных осложнений у родильниц.
4.8.4. Биопсия ворсин хорионаС помощью этой диагностической процедуры получают клетки ворсинчатого хориона для кариотипирования плода при необходимости цитогенетической диагностики хромосомных заболеваний, а также для определения пола плода. Манипуляцию проводят как трансцервикально, так и трансабдоминально в ранние сроки беременности (10—14 нед) или трансабдоминально в 20—24 нед под эхографическим контролем. Взятие хориальной ткани осуществляют путем аспирации. Противопоказаниями являются угроза прерывания беременности и инфекционное поражение половых путей.
Среди осложнений отмечаются кровотечения, формирование субхориальных гематом, прерывание беременности, внутриутробное инфицирование.
4.8.5. ФетоскопияДля уточнения наличия аномалии развития плода путем непосредственного его осмотра используют фетоскопию. С помощью этого метода через эндоскоп, трансабдоминально введенный в амниотическую полость, осматривают части плода и при необходимости берут образцы околоплодных вод, крови или тканей плода. Противопоказания — угроза прерывания беременности и внутриутробное инфицирование.
Среди осложнений фетоскопии встречаются несвоевременное излитие околоплодных вод, преждевременное прерывание беременности, реже бывают кровотечения и внутриутробное инфицирование.
Глава 5. ОСНОВНЫЕ ИЗМЕНЕНИЯ В ОРГАНИЗМЕ ЖЕНЩИНЫ ВО ВРЕМЯ БЕРЕМЕННОСТИВо время беременности возникает новая функциональная система мать — плацента — плод, обусловливающая множество изменений в организме женщины.
Мать и плод взаимно влияют друг на друга через плаценту, которая, с одной стороны, объединяет их, с другой — обеспечивает определенную автономность плоду.
Чаще всего здоровые молодые женщины рождают здоровых детей. Но нельзя окончательно утверждать, что больная женщина может родить только больного ребенка. Полноценная генетическая программа, заложенная в яйцеклетке и сперматозоиде, нормальное развитие плодного яйца, плода и плаценты обеспечивают необходимые условия для рождения здорового ребенка.
Важное значение для нормального развития беременности имеют образ жизни, питание, психологический настрой, отказ от вредных привычек.
5.1. Роль плаценты. Гормональная и белково-образующая функция плацентыВсе изменения, происходящие в организме женщины во время беременности, носят адаптационный характер и направлены на создание оптимальных условий для развития плода.
С первых недель наступления беременности вплоть до ее окончания формируется структурное и функциональное единство — система мать — плацента — плод. Основой этого единства является плацента, точнее — послед. Послед — это система жизнеобеспечения плода, комплексный орган, в формировании которого принимают участие производные трофобласта и эмбриобласта, а также децидуальная ткань и сосуды матки.
Плацента выполняет целый ряд важнейших функций, направленных на обеспечение достаточных условий для физиологического течения беременности и нормального развития плода. К этим функциям относятся дыхательная, трофическая, выделительная, защитная, эндокринная.
На протяжении 10 лунных месяцев (280 дней) послед проходит весь жизненный цикл развития: зарождение, развитие, функциональный расцвет и старение. При этом все составные компоненты последа неуклонно связаны с развитием и потребностями плода.
Плацента — комплексный провизорный орган, в образовании которого принимают участие ткани матери и плода. Все метаболические, гормональные, иммунные процессы во время беременности обеспечиваются через сосудистую систему матери и плода. И хотя кровь матери и плода не смешивается, так как их разделяет плацентарный барьер, все необходимые питательные вещества и кислород плод получает из крови матери. Основным структурным компонентом плаценты является виллезное дерево, представленное стволовыми ворсинами, незрелыми промежуточными ворсинами, мезенхимальными ворсинами (I—II триместры беременности), а также зрелыми промежуточными и терминальными ворсинами (III триместр беременности).
Следует подчеркнуть, что не только мать и плацента обеспечивают жизнедеятельность плода, но и плод на протяжении всей беременности выделяет факторы роста для развития виллезного дерева плаценты. В начале формирования беременности (эмбриональный период) происходит разрастание и дифференцировка эмбриональных, фетальных сосудов, а потом мезенхимальных ворсин трофобласта. Возрастает перфузионное давление в капиллярах ворсин хориона, что стимулирует плацентарный ангиогенез.
При нормальном развитии беременности имеется корреляционная зависимость между ростом плода, его массой тела и размерами, толщиной, массой плаценты.
До момента образования синцитиокапиллярных мембран (16 нед беременности) развитие плаценты опережает темпы роста плода. В случае смерти эмбриона (плода) происходит торможение роста и развития ворсин хориона и прогрессирование инволюционно-дистрофических процессов в плаценте. Достигнув необходимой зрелости (38—40 нед беременности), в плаценте прекращаются процессы неоангиогенеза, новообразования и созревания ворсин хориона.
Высокая гормональная насыщенность организма матери эстрогенами и прогестероном размягчает соединения костей таза; обеспечивает процессы гипертрофии, гиперплазии, растяжения и сокращения матки; снижает тонус мочеточников и мочевого пузыря.
Необходимо подчеркнуть, что, несмотря на существование раздельных систем кровообращения в матке и в плаценте, которые отделены друг от друга плацентарной мембраной, гемодинамика матки теснейшим образом связана с плодово-плацентарным кровотоком. Поэтому повышение тонуса матки или ухудшение состояния плода вследствие снижения кровотока неизменно влияют друг на друга, что выражается в клинической картине угрожающего преждевременного прерывания беременности. Капилляры хориона пульсируют соответственно сердцебиению плода, оказывая влияние на циркуляцию материнской крови через межворсинчатое пространство.
Гормональной функции плаценты принадлежит ведущая роль в регуляции обменных процессов и специфических изменений в системе мать — плацента — плод для обеспечения адекватных условий сохранения и нормального прогрессирования беременности.
Представление о физиологических механизмах регуляции гестационного процесса является основой для понимания генеза многих форм акушерской патологии и выработки патогенетически обоснованной терапии различных осложнений беременности.
В процессе развития беременности плацента синтезирует практически все известные гормоны женского организма, используя материнские и плодовые предшественники.
Каждый из гормонов, которые продуцируются плацентой, соответствует гипофизарному или гипоталамическому гормону по биологическим и иммунологическим свойствам, а также известным стероидным половым гормонам.
Среди гормонов, аналогичных
гипофизарным, плацента вырабатывает:
• хорионический гонадотропин (ХГ);
• плацентарный лактоген (ПЛ);
• хорионический тиреотропин;
• предполагается существование плацентарного кортикотропина.
Кроме того, плацента продуцирует
родственные АКТГ пептиды, включая -эндорфины и -меланостимулирующий гормон.
К гормонам, которые аналогичны
гипоталамическим, относятся:
• гонадотропин-рилизинг-гормон;
• тиреотропин-рилизинг-гормон;
• соматостатин.
Отличие плаценты от других эндокринных органов заключается также и в том, что она продуцирует одновременно различные по своей структуре гормоны — белковой и стероидной природы.
Гормонами белковой природы, которые синтезируются плацентой, являются:
• хорионический гонадотропин;
• плацентарный лактоген;
• пролактин;
• хорионический тиреотропин.
Из
стероидных гормонов плацента синтезирует прогестерон и эстрогены (эстрон, эстриол, эстрадиол).
Плацентарные гормоны вырабатываются децидуальной тканью, синцитио- и цитотрофобластом.
До недавнего времени децидуальная и фетальные оболочки не рассматривались как активные эндокринные образования. В настоящее время получены данные о том, что эти структурные элементы синтезируют и метаболизируют ряд гормонов, а также отвечают на гормональные воздействия (судя по наличию в них соответствующих рецепторов). Децидуальная оболочка имеет тесный контакт с плодом через амниотическую полость и подлежащий миометрий и считается зоной взаимного влияния матери и плода посредством гормонов и рецепторов.
Следует подчеркнуть, что плацента в определенной степени является автономным, саморегулирующимся органом, независимым от гипоталамо-гипофизарных регуляторных воздействий. Секреция плацентарных гормонов не управляется механизмами, контролирующими выработку гормонов эндокринными железами.Хорионический гонадотропин является гликопротеидом, имеет определенное структурное и функциональное сходство с пролактином. ХГ синтезируется главным образом в синцитиотрофобласте, а также в синцитиальных почках и свободных симпластах.
Подобно всем гликопротеидным гормонам ХГ состоит из двух субъединиц: а и (3. Если не считать очень слабых различий, -субъединица одинакова у всех гликопротеидных гормонов, а (3-субъединица определяет их специфичность.
Начиная с ранних сроков беременности, ХГ выполняет лютеотропную функцию, поддерживая стероидогенез в желтом теле яичниками и способствуя его превращению в желтое тело беременности. Биологическое действие ХГ имитирует активность фолликулостимулирующего гормона (ФСГ) и пролактина, стимулируя функциональную активность желтого тела и непрерывную продукцию прогестерона. В свою очередь прогестерон определяет степень развития деци-дуальной оболочки.
ХГ способствует синтезу эстрогенов в фетоплацентарном комплексе, а также участвует в процессе ароматизации андрогенов плодового происхождения. При этом ХГ регулирует и стимулирует продукцию стероидов у плода, так как с его участием в корковом веществе надпочечников плода секретируется ДГЭА-сульфат, а яички плода мужского пола выделяют тестостерон. Таким образом, ХГ влияет на формирование функциональной активности гонад и надпочечников плода.
Нарастание уровня ХГ, а также синтезируемых желтым телом и плацентой стероидных гормонов приводит к торможению циклической секреции гипофизарных гонадотропных гормонов, что проявляется низким содержанием в крови беременных ФСГ и пролактина.
ХГ способствует торможению иммунологических реакций организма беременной путем индукции супрессорных Т-клеток, препятствуя отторжению плодного яйца. Сегодня ХГ рассматривается как основной иммунодепрессант в предотвращении иммуноконфликта и отторжения плода.
Гормон оказывает также тиреоидстимулирующий эффект, так как в молекуле ХГ обнаружены участки, обеспечивающие взаимодействие с рецепторами тиреотропного гормона (ТТГ).
В ранние сроки беременности экскреция ХГ с мочой отражает гормональную функцию трофобласта. С мочой гормон начинает выделяться со 2-й недели, достигая наивысшего уровня в 10 нед, после чего его концентрация уменьшается и поддерживается на определенном уровне до окончания беременности (с повторным пиком в 32— 34 нед).
Следует подчеркнуть, что методика определения ХГ в моче имеет недостатки из-за низкой чувствительности и малой специфичности, что нередко обусловлено перекрестной реакцией с пролактином. Кроме того, показатели уровня ХГ в моче обладают инертностью во времени, варьируя в достаточно широких индивидуальных пределах. Так, уже при начавшемся самопроизвольном аборте и смерти плода ХГ часто снижается очень медленно и какое-то время может давать положительный результат, свидетельствующий о нормальной гормональной функции.
Следовательно, из-за возможности ложных результатов с диагностической точки зрения определение ХГ в моче может считаться ориентировочным тестом.
ХГ в сыворотке материнской крови выявляется уже на 8—9-й день после зачатия. В I триместре беременности концентрация ХГ повышается очень быстро, удваиваясь каждые 2—3 дня, достигая максимума на 8—10-й неделе беременности. После этого концентрация гормона начинает снижаться и в течение второй половины беременности остается относительно постоянной. Кроме целых, недиссоциированных молекул ХГ, в периферической крови циркулируют также и свободные - и -субъединицы гормона. Большинство используемых тест-систем предназначено для определения уровней недиссоциированной молекулы ХГ, что позволяет измерять содержание свободных субъединиц молекулы гормона.
Целесообразно также определять -субъединицу ХГ в крови беременных. Данный метод обладает более высокой чувствительностью, позволяет избежать диагностических ошибок и дает возможность установить наличие беременности в самые ранние ее сроки. Методика пригодна для диагностики эктопической беременности.
При патологии трофобласта, которая чаще всего сопровождается неразвивающейся беременностью или угрозой ее прерывания, отмечается снижение уровня ХГ.
Повышенное содержание гормона может быть обусловлено наличием многоплодной беременности, патологической пролиферацией клеток трофобласта при пузырном заносе или хромосомными аберрациями у плода.
Плацентарный лактон (хорионический соматомаммотропин) имеет биологическое и иммунологическое сходство с гормоном роста гипофиза (его называют гормоном роста беременных). Название «плацентарный лактоген» гормон получил из-за предполагаемого лактогенного эффекта.
ПЛ способствует стимуляции формирования секреторных отделов молочных желез у беременных. Этот гормон в синергизме с ХГ поддерживает стероидогенез в желтом теле яичника, стимулирует развитие плода (эпифизарный рост костей).
Важная биологическая роль ПЛ заключается в регуляции углеводного и липидного обмена. Гормон стимулирует выделение инсулина, оптимизирует утилизацию глюкозы в организме матери, сберегая ее для плода, способствует накоплению жира, обеспечивает увеличение содержания в плазме свободных жирных кислот, создавая необходимый энергетический резерв.
Считается, что ПЛ относится к метаболическим гормонам, обеспечивающим плод питательными веществами.
Источником энергии для плода являются кетоновые тела, которые образуются из жирных кислот, проникающих через плаценту. Кетогенез также регулируется ПЛ.
Итак, ПЛ регулирует метаболические процессы в организме матери, направленные на мобилизацию энергетических ресурсов для роста и развития плода. Гормон оказывает катаболическое действие, сохраняя адекватное поступление субстратов для метаболических систем плода.
В I триместре беременности основной синтез ПЛ осуществляется вневорсинчатым цитотрофобластом. В более поздние сроки гормон синтезируется синцитиотрофобластом ворсин. Большая часть ПЛ — 90% — поступает в кровь беременной, а остальные 10% попадают в околоплодные воды и к плоду.
Гормон определяется в сыворотке крови беременной радиоиммунологическим методом начиная с 5—6-й недели. В связи с увеличением функциональной активности и массы плаценты продукция гормона нарастает и достигает максимальных значений к 36—38 нед, после чего происходит некоторое снижение его концентрации. Действие гормона определяет метаболическую и биосинтетическую функции синцитиотрофобласта.
Колебания индивидуальных показателей ПЛ обусловлены размерами плаценты и массой плода.
Клиническое значение определения уровня ПЛ в сыворотке крови обусловлено тем, что снижение концентрации гормона свидетельствует о нарушении функции плаценты.
Многоплодная беременность приводит к увеличению концентрации гормона пропорционально массе и числу плацент.
При ФПН и нарушении эндокринной функции плаценты падение уровня СМТ как основного метаболического гормона беременности является одним из патогенетических факторов задержки развития плода.
Во второй половине беременности прогностическое значение имеет только низкий уровень ПЛ. Выраженная ФПН, как правило, сопровождается снижением концентрации ПЛ более чем на 50% по сравнению с нормативными показателями, характерными для данного срока беременности. Об антенатальной смерти плода свидетельствует уменьшение уровня гормона на 80% и более.
При угрозе прерывания беременности снижение уровня ПЛ является одним из ранних диагностических признаков.
Учитывая, что изменение выработки гормона находится в прямой зависимости от массы плаценты, а также от степени тяжести и длительности осложнения, оценка уровня ПЛ должна быть дифференцированной. Так, при сахарном диабете и при гемолитической болезни плода сопутствующая им макросомия и увеличение массы плаценты маскирует снижение уровня ПЛ, что не отражает истинного состояния фетоплацентарной системы.
Пролактин (лютеотропный гормон, ЛТГ) преимущественно синтезируется в децидуальной оболочке и в передней доле гипофиза. Регуляторные механизмы децидуальной и гипофизарной продукции пролактина различны. Это, в частности, доказывается тем, что дофамин не тормозит продукцию гормона децидуальной оболочкой.
Количество циркулирующего в крови беременных пролактина, который определяется радиоиммунологическим методом, возрастает уже в I триместре (5—6 нед) и ко времени родов в 10 раз превышает исходный уровень.
Основным стимулятором пролактина являются эстрогены.
Структурное сходство пролактина с ПЛ обусловливает его физиологическую роль в регуляции функции молочных желез. Кроме того, пролактин имеет определенное значение в синтезе сурфактанта и в процессе фетоплацентарной осморегуляции, что связано с его воздействием на осмотические процессы в стенке амниона.
Хорионический тиреотропин синтезируется плацентой и является гормоном белкового происхождения. По своим физико-химическим, иммунологическим и гормональным свойствам близок к ТТГ гипофиза. Исходя из этого выявлено, что хорионический тиреотропин поддерживает секрецию тиреоидных гормонов. Тиреоидстимулирующее действие наиболее выражено в ранние сроки беременности, а затем несколько снижается.
Специфическая роль гормона во время беременности полностью еще не изучена. Однако отмечено, что активация функции щитовидной железы (а иногда и гипертиреоз) выявляется при пузырном заносе и других опухолях трофобласта.
Хорионический кортикотропин, синтезируемый трофобластом, обладает кортикотропной активностью. Гормон вызывает резистентность гипофиза к действию глюкокортикостероидов по механизму обратной связи.
Плацента синтезирует также родственные АКТГ пептиды, к которым, в частности, относится
-эндорфиноподобный пептид, аналогичный по действию синтетическому (-эндорфину. При этом синтез гормона идентичен гипофизарному. Напомним, что в гипофизе синтезируется гормон-предшественник гликопротеид, названный проопиомеланокортином. От него отщепляется АКТГ и группа пептидов, включающая -липотропин, -эндорфин и -меланостимулирующий гормон. То же самое происходит и в плаценте.
Биологическая роль -эндорфина еще мало изучена. Уровень этого вещества во время беременности очень низкий (около 15 пг/мл). Во время потуг количество -эндорфина возрастает в 5 раз, а при рождении плода —в 7,5—10 раз. Схожие концентрации -эндорфина (105 нг/мл) отмечены в крови пуповины плода к началу родов.
Источником синтеза -эндорфиноподобного пептида для обезболивания плода в процессе его прохождения через родовые пути является плацента. Возможно также в этом участвует и гипофиз плода, так как многие факторы, повышающие уровень гипофизарного АКТГ увеличивают и концентрацию -эндорфина. Гипоксия и ацидоз могут вызвать повышение уровня -эндорфина, а также -липотропина и АКТГ.
Как уже было отмечено, плацента синтезирует такие гормоны, как
гонадотропин-рилизинг-гормон, тиреотропин-рилизинг-гормон, кортикотропин-рилизинг-гормон, которые аналогичны гипоталамическим гормонам. Вполне вероятно, что плацента синтезирует и другие гормоны — рилизинги, которые вырабатываются цитотрофобластом.
В плаценте выявлен
соматостатин, который вырабатывается цитотрофобластом. Отмечено, что по мере прогрессирования беременности синтез гормона уменьшается. При этом снижение продукции соматостатина трофобластом сопровождается усилением секреции ГОТ.
Цитотрофобластом синтезируется
релаксин, который является гормоном, относящимся к семейству инсулинов. Релаксин оказывает релаксирующее воздействие на матку, снижает ее сократительную активность, увеличивает растяжимость ткани шейки матки и эластичность лобкового симфиза. Такое действие гормона обусловлено его влиянием на рецепторы, расположенные в амнионе и хорионе. Это в свою очередь способствует активации специфических ферментов, под воздействием которых происходит деградация коллагена и уменьшение синтеза новых коллагеновых элементов.
Эстрогены (эстрадиол, эстрон и эстриол) являются стероидными половыми гормонами, также образуются в фетоплацентарной системе.
В начале беременности, когда плацента еще не сформирована как эндокринный орган и не функционирует корковое вещество надпочечников плода, основное количество эстрогенов вырабатывается в желтом теле яичников матери.
В 12—15 нед беременности продукция эстрогенов возрастает, а среди их фракций начинает преобладать
эстриол (Э3). При этом соотношение фракций эстрогенов эстриол — эстрон — эстрадиол составляет 30:2:1. В конце беременности количество эстриола увеличивается в 1000 раз по сравнению с исходным состоянием.
Холестерин, синтезируемый в организме беременной, в плаценте преобразуется в прегненолон и в прогестерон. Плацентарный прегненолон поступает в организм плода и наряду с плодовым прегненолоном в надпочечниках плода трансформируется в дегидроэпиандростерон-сульфат (ДГЭА-сульфат).
В печени плода ДГЭА-сульфат гидролизуется до 16-ОН-ДГЭА-сульфата, который переходит в плаценту, где под воздействием сульфатаз и ароматазы превращается в эстриол.
В печени беременной образуются соединения эстриола с глюкуроновой кислотой — глюкурониды и сульфаты, которые выводятся из организма в основном с мочой и в небольшом количестве с желчью.
Большая часть (90%) циркулирующего в крови беременных эстриола образуется из андрогенных предшественников плодового происхождения, 10% эстриола синтезируется в надпочечниках матери.
Плацента и плод представляют собой единую, функционально взаимосвязанную систему синтеза эстрогенов, которые ни плацента, ни плод в отдельности не в состоянии продуцировать в достаточном количестве.
Эстрогены участвуют в регуляции биохимических процессов в миометрии, обеспечивают нормальный рост и развитие матки во время беременности, влияют на ее сократительную активность, увеличивают активность ферментных систем, способствуют повышению энергетического обмена, накоплению гликогена и АТФ, которые необходимы для развития плода. Эстрогены также вызывают пролиферативные изменения в молочных железах и в синергизме с прогестероном участвуют в подготовке их к лактации.
Учитывая, что секреция эстриола преобладает во время беременности над другими фракциями эстрогенов и зависит от предшественников синтезируемых надпочечниками и печенью плода, уровень этого гормона в крови беременных и экскреция его с мочой в большей степени отражают состояние плода, чем плаценты.
При нарушениях со стороны плода уменьшается продукция 16-ОН-ДГЭА, что приводит к уменьшению синтеза эстриола плацентой. Угнетение ферментативной активности плаценты также сопровождается уменьшением выработки Э3.
Эстриол в крови беременных определяют при помощи радиоиммунологического метода с учетом суточных колебаний уровня гормона.
Для определения уровня эстриола в моче используют метод хроматографии.
В первые недели беременности содержание эстрогенов в крови и экскреция их с мочой находится на уровне, соответствующем активной фазе желтого тела у небеременных женщин.
Дальнейшее развитие физиологической беременности сопровождается возрастанием количества эстриола в крови и моче. Учитывая широкие колебания уровня эстриола в течение беременности, рекомендуется проводить повторные динамические исследования гормона, что является более надежным тестом, чем однократная диагностика.
Выраженное снижение, постоянно низкая величина или недостаточный подъем уровня эстриола указывают на нарушения со стороны фетоплацентарной системы.
Для подтверждения ФПН используют также соотношение количества эстриола в плазме крови и в моче, выражающееся эстриоловым индексом, который уменьшается по мере прогрессирования осложнения.
Патологические состояния, связанные с нарушением маточно-плацентарного и фетоплацентарного кровотока, затрудняют обмен предшественников синтеза эстрогенов между плацентой и плодом, нарушают ферментативную активность плаценты, отрицательным образом влияют на процессы жизнедеятельности плода.
Наиболее часто низкие значения эстриола в крови беременных имеют место при наличии задержки развития плода, гипоплазии его надпочечников, анэнцефалии, синдроме Дауна, внутриутробной инфекции и смерти плода.
Снижение экскреции эстриола с мочой до 12 мг/сут и менее свидетельствует о выраженном нарушении фетоплацентарного комплекса.
Терапия кортикостероидами во время беременности вызывает подавление функции коркового вещества надпочечников плода, что приводит к снижению уровня синтеза гормона.
Аналогичный результат может быть получен на фоне приема беременной ампициллина из-за нарушения метаболизма в кишечнике и сокращения объема эстриол-3-глюкуронида, возвращающегося в печень.
Тяжелые заболевания печени у беременной могут приводить к нарушению конъюгации эстрогенов и повышенному выведению их с желчью.
При нарушении функции почек у беременной и снижении клиренса эстриола также происходит уменьшение содержания гормона в моче и повышение его в крови, что не может адекватно отражать состояние плода.
В ряде случаев могут иметь место дефекты ферментных систем плаценты (недостаточность сульфатазы), которые являются причиной низкого значения эстриола при нормальном состоянии плода.
Наличие крупного плода, а также многоплодной беременности нередко влечет за собой повышение уровня эстриола.
Прогестерон является одним из наиболее важных гормонов, влияющих на развитие беременности, и обладает многообразием функций. Под действием этого гормона происходит децидуальная трансформация эндометрия, обеспечивающая имплантацию плодного яйца. Прогестерон подавляет сократительную активность матки и способствует поддержанию тонуса ее истмико-цервикального отдела, создавая опору для растущего плодного яйца. Обладая иммуносупрессивным действием, прогестерон влияет на подавление реакций отторжения плодного яйца, является предшественником синтеза стероидных гормонов плода, а также влияет на обмен натрия в организме беременной, способствуя увеличению объема внутрисосудистой жидкости и адекватному удалению продуктов метаболизма плода.
Нарушение перечисленных функций вследствие снижения уровня прогестерона, особенно в ранние сроки беременности, значительно увеличивает риск ее прерывания и создает предпосылки для развития ФПН.
Кроме того, прогестерон усиливает пролиферативные процессы в молочных железах, подготавливая их к лактации.
На начальных этапах развития беременности (первые 6 нед) основным источником прогестерона является желтое тело, функция которого стимулируется ХГ в синергизме с ПЛ. Постепенно, к 7—8-й неделе беременности, основную функцию в синтезе прогестерона начинает выполнять плацента.
С начала II триместра беременности плацента синтезирует достаточное количество прогестерона, которое может обеспечить нормальное развитие беременности даже при отсутствии яичников. При этом гормон способен накапливаться в различных тканях, создавая своеобразные депо для поддержания его концентрации на должном уровне. В течение всей беременности концентрация прогестерона в крови постоянно возрастает в соответствии с увеличением функционирующей ткани плаценты, достигая своего пика в 38—39 нед.
Автор:
Сидорова И.С., Кулаков В.И., Макаров И.О.
Источник:
Книга
Наименование источника:
Руководство по акушерству
Просмотров:
497
Предыдущая Страница 123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384 из 84
Следующая